RESUMEN
La anemia de células falciformes (ACF) es una enfermedad de herencia autosómica recesiva, causada por mutaciones puntuales en el gen HBB. Los individuos con alteración en la hemoglobina S pueden ser heterocigotos u homocigotos. Objetivo: El presente trabajo tuvo como objetivo conocer el genotipo de pacientes clínicamente diagnosticados con ACF a través de PCR-RFLP, como un método alternativo a la electroforesis de hemoglobinas, para ser utilizado en el diagnóstico de ACF. Método: La muestra del estudio fueron 63 pacientes con diagnóstico clínico de ACF, a quienes se les tomó 5 ml de sangre para extracción de ADN, amplificación y digestión con enzima de restricción Eco81I (Bsu36I). Los fragmentos se corrieron en electroforesis de Agarosa al 2%, y se identificó el genotipo de los pacientes en estudio. Resultados: El 34.4% de los niños eran de 0-5 años, predominando el sexo masculino con 61%, el 53% procedían de Managua. En relación con su genotipo el 82.5% de los pacientes presentaban ACF en su estado homocigoto, 3.2% ACF heterocigotos, y en el 14.3% de los casos, los electroferogramas no eran compatibles con ACF. Conclusiones: En este estudio, la mayoría de los niños que buscan asistencia por anemia falciforme en el Hospital Manuel de Jesús Rivera “La Mascota”, son homocigotos (82.5%), mientras que sólo un 3.2% son heterocigotos, lo cual es de esperar, conociendo la presentación clínica de ambos estados. El 14.3% de los electroferogramas (9 niños), no fueron consistentes con anemia falciforme, lo que nos conduce a la necesidad de examinar otros tipos de hemoglobinopatías.
Palabras Clave:
Anemia drepanocítica, Hemoglobina S, PCR-RFLP
ABSTRACT
Sickle cell anemia (ACF) is an autosomal recessive inheritance disease, caused by point mutations in the HBB gene. Individuals with altered hemoglobin S can be heterozygous or homozygous. Objective: The present work had as objective to know the genotype of patients clinically diagnosed with ACF through PCR-RFLP, as an alternative method to be used for the diagnosis of ACF. Method: The study sample was 63 patients with a clinical diagnosis of ACF, who took 5 ml of blood for DNA extraction, amplification and digestion with the restriction enzyme Eco81I (Bsu36I), which was subsequently run Agarose electrophoresis at 2% with the samples obtained from the digestion with which the genotype of the study patients was identified. Results: It was found that 34.4% of the children were 0-5 years old, the male sex being predominant with 61%, 53% came from Managua. In relation to their genotype, 82.5% of the patients presented ACF in their homozygous state, 3.2% heterozygous ACF and 14.3% did not present ACF results. Conclusions: In this study, most children seeking care for sickle cell anemia at the Manuel de Jesús Rivera Hospital “La Mascota” were homozygous (82.5%), while only 3.2% were heterozygous, which is expected given the clinical presentation of both conditions. Nine children (14.3%) of the electropherograms were not consistent with sickle cell anemia, which highlights the need to examine other types of hemoglobinopathies.
Key Words:
Sickle cell Anemia, Hemoglobin S, PCR-RFLP
INTRODUCCIÓN
La anemia de células falciforme (ACF), también llamada anemia drepanocítica es una enfermedad de herencia autosómica recesiva, causada por mutaciones puntuales en el gen HBB, localizado en el brazo corto del cromosoma 11, locus 15.5. La variante alélica βS es originada por la sustitución de (GAG→GTG: Glu→Val) en la posición 6 de la cadena β de la globina1,2,3.
Los pacientes con hemoglobina S pueden ser heterocigotos para hemoglobina S (Hb AS), es decir son portadores, y tienen manifestaciones clínicas solo bajo ciertos estímulos, o bien, homocigotos, (Hb SS) lo cual corresponde a la ACF1,2,3. La forma homocigota es la que se hace evidente a través de los síntomas y signos clínicos, como la oclusión de vasos sanguíneos por masas de hematíes en forma de hoz (media luna), entre los que destaca el dolor agudo, síndrome torácico agudo, priapismo, secuestro esplénico y la susceptibilidad aumentada a la infección por diversos agentes y daños progresivos en diferentes órganos1,2,3.
La anemia de células falciforme fue la primera enfermedad de origen genético reportada en el mundo, y en la actualidad es una de las hemoglobinopatías más frecuentes. En todo el mundo hay unos 7,7 millones de personas con anemia de células falciformes, una cifra que ha aumentado más del 40 % desde el año 2000. Se estima que la anemia de células falciformes causa más de 375 mil muertes cada año. Su prevalencia es alta en África ecuatorial, pero se encuentra también en la cuenca del mediterráneo, en regiones de la India, Arabia Saudita y en las poblaciones de origen africano de América del Norte, América Central, América del Sur y el Caribe4 . Las hemoglobinopatías causan aproximadamente un 3.4% de las defunciones entre los niños menores de 5 años. De acuerdo con la Organización Mundial de la Salud (OMS), cada año nacen más de 330 mil niños afectados, en donde el 83% de los casos corresponde a anemia de células falciformes y 17% a talasemia. En países de alta prevalencia se han implementado programas de tamizaje neonatal, para detectar tempranamente la ACF e iniciar tratamiento preventivo temprano, así como asesoramiento apropiado a los padres y una atención primaria adecuada a los afectados5,6.
En Latinoamérica los países que más han reportado ACF son Cuba, Brasil, Colombia, entre otros7 , Cuba es uno de los países con más casos reportados, por lo que establecieron un Programa Nacional de Diagnóstico y Prevención de Anemia por Hematíes Falciforme, en el cual se realiza pesquizaje a embarazadas, indicando la electroforesis de hemoglobina en el momento de la captación y posterior estudio a la pareja de la gestante, si ésta resulta ser portadora (AS o AC), lo que permite la identificación de las parejas de alto riesgo, a las que se les brinda la posibilidad del diagnóstico prenatal por estudios basados en ADN o bien la asesoría genética8 .
Cervera I. et al.9 usaron PCR-ARMS y PCR-RFLP para detectar la presencia de los alelos βA, βS y βC, en 270 muestras de ADN de fetos concebidos por parejas con riesgo de tener descendencia afectada por ACF. En tanto García-Heredia et al.10 estudiaron 1,855 muestras de líquido amniótico para diagnóstico molecular de ACF. Ambos estudios utilizaron la técnica de PCR-ARMS y PCR-RFLP, destacando que el método PCR-RFLP tiene ventajas con respecto a PCR-ARMS, ya que usa una pequeña cantidad de muestra biológica, y aseguran el diagnóstico prenatal de hemoglobina S, lo que permite el adecuado asesoramiento genético a las parejas en riesgo y una atención médica especializada a los nacidos con la enfermedad.
En Nicaragua se han realizado diversos estudios de ACF en el Hospital infantil Manuel de Jesús Rivera “La Mascota”, principalmente para evaluar la epidemiología y el comportamiento clínico de la enfermedad, el que está acompañado por técnicas inespecíficas de laboratorio como: BHC, plaquetas, extendido periférico, reticulocitos, test de falciformación, y pruebas de química sanguínea12,13, ya que los métodos moleculares no están disponibles en el hospital, por lo que no es posible la identificación de los individuos homocigotos y heterocigotos. Por tanto, nos hemos planteado realizar este estudio en pacientes clínicamente diagnosticados con ACF, aplicando herramientas moleculares como diagnóstico de laboratorio a través de la reacción en cadena de la polimerasa (PCR) de fragmentos de restricción de longitud polimorfa (RFLP), ya que es una técnica robusta y más económica en comparación a la electroforesis de hemoglobina lo que va a facilitar el diagnóstico temprano y oportuno de los pacientes, aplicación de esquemas de tratamiento acorde al genotipo, por lo tanto a mejorar la calidad de vida de los pacientitos con esta enfermedad.
MATERIAL Y MÉTODOS
El presente estudio es descriptivo de corte transversal, realizado a niños con diagnóstico clínico de anemia drepanocitica en el Hospital Infantil Manual de Jesús Rivera “La Mascota” Managua. El universo lo constituyeron 215 pacientes en el momento del estudio, del cual se obtuvo una muestra de 63 pacientes que cumplieron con los criterios de inclusión de ser atendido en el hospital y tener diagnóstico clínico de ACF.
Para la toma de muestra de sangre de los pacientes, se les explico a los padres la importancia y utilidad del estudio, lo padres que estuvieron de acuerdo firmaron el consentimiento informado, así como el llenado de un cuestionario estructurado con información sociodemográfica de los pacientes (edad, sexo, procedencia) y datos clínicos de la enfermedad. También se le informo a los padres que la muestra obtenida no representaba ningún peligro para el niño y se garantizó la confidencialidad de los datos obtenidos.
La toma de la muestra de sangre se realizó en el Hospital Infantil Manual de Jesús Rivera “La Mascota”, de los 5ml de sangre total se extrajo el ADN para su posterior estudio a través del método PCR-RFLP, en el cual se valoraría la condición genotípica de la ACF en su estado homocigoto o heterocigoto. El análisis de las muestras se realizó en el Laboratorio Central del Sector Salud de UNAN-Managua, en donde se realizaron los procesos de extracción de ADN, amplificación y digestión enzimática de las muestras en estudio, las que fueron posteriormente sometidas a electroforesis en gel de agarosa. La información se procesó en SPSS y los resultados fueron presentados en tablas y gráficos.
PROCEDIMIENTOS REALIZADOS
Extracción de ADN genómico: Para la extracción del ADN se utilizó el kit de QIAamp DNA Mini Kit de QIAGEN, y una vez extraído el ADN se realizó control de calidad para ver concentración, pureza e integridad del ADN.
Amplificación de los alelos βS: Para la amplificación del alelo se utilizó 100 ng ADN, 10 µM de los cebadores BCD6 y BCD7, 5 µl de ADN, 25 µl de Hot Start Taq 2x Máster Mix, el que se completó con 18 µl de agua grado biología molecular para un volumen final de 50 µl. Las muestras fueron amplificadas en termociclador GeneAmp PCR System 9700.
Digestión enzimática: Se efectuó en un volumen final de 30 µL, que contenía 20 unidades de la enzima de restricción Eco81I (Bsu36I) de Thermo Scientific, al que se le añadió 2µL de 1X/ 2X del tampón de la enzima (Tango) con BSA, 10 µL del alelo amplificado y 16 µL de agua grado biología molecular, incubándose a 37°C por 4 horas.
Electroforesis en gel de agarosa: Las muestras digeridas fueron sometidas a electroforesis en gel de agarosa NuSieve 3:1 (Lobanza) al 2% con bromuro de etidio, a 100 Voltios durante 40 minutos, usando 1X de Tris-Ácido Bórico-EDTA (TBE) como tampón de corrida, posteriormente las bandas se visualizaron en un transiluminador ultravioleta.
RESULTADOS
Los resultados obtenidos en este estudio con respecto a los datos sociodemográficos de los pacientes fueron los siguientes: el rango de edad fue de 1-16 años, encontrándose el 34.4% de 0-5 años, 32.8% de 6-11 años y el 32.8% de 12-18 años. Con relación al sexo, predominó el sexo masculino con 61% y el femenino con 39%.
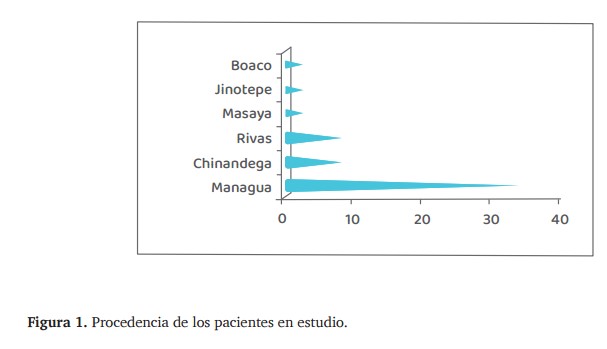
Con relación a la procedencia se encontró que la mayoría de los pacientes proceden de Managua con 34 casos (53%), 8 de Chinandega y Rivas (12.5%), 2 procedentes de Masaya, Jinotega y Boaco, respectivamente, lo que corresponde al 3.1%, y un caso en cada uno de los siguientes departamentos y municipios: Estelí, Nueva Guinea, Pueblo Nuevo, León, Niquinohomo, Granada, Tipitapa y Bluefields, (figura. 1).
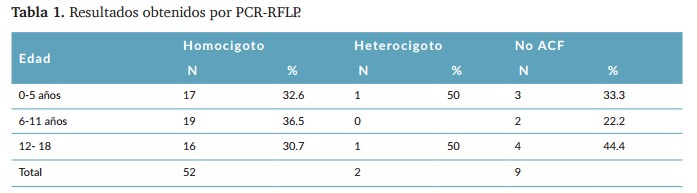
En relación con los resultados de la digestión enzimática, se encontró que el 82.5% de los pacientes presentan ACF en su estado homocigotos, 3.2% ACF heterocigotos y el 14.3% no presentaron resultados de ACF. Los resultados por edad están expresados en la (tabla 1), reflejando que el mayor número de casos homocigotos se presentó en las edades de 6-11 años.
DISCUSIÓN DE RESULTADOS
Este estudio se realizó con 63 pacientes clínicamente diagnosticados con ACF, los que se encontraban entre 1-16 años, predominando el grupo etario de 0-5 años con el 34.4% (22) al momento del estudio. Este rango de edad coincide con lo reportado por2,3 ya que es la etapa en que los niños presentan la fase aguda de la enfermedad, sin embargo, es importante mencionar que muchos de los pacientes que al momento del estudio estaban fuera de ese rango, fueron diagnosticados entre los seis y doce meses del nacimiento, o bien en este rango de edad.
El sexo masculino predominó sobre el femenino con 61% (39), varios estudios han reportado que el sexo no tiene ninguna influencia en quienes padecen ACF1,3.
Hospital Infantil Manual de Jesús Rivera “La Mascota” es el hospital del niño de referencia nacional, por lo que se atiende a pacientes provenientes de diferentes regiones del país. En este estudio el 53% (34) de los pacientes eran de Managua, 12.5% (8) Chinandega y Rivas, así como de otros departamentos. La mayor presencia de estos pacientes en Managua probablemente se deba a que algunas poblaciones principalmente de descendencia africana hayan migrado del campo a la ciudad.
La ACF no ha sido investigada por métodos moleculares basados en ADN en Nicaragua, éste, es el primer estudio realizado con diagnóstico molecular por PCR-RFLP, encontrando los siguientes resultados: el 82.5% (52) de los pacientes presentaron ACF en estado homocigoto, 3.2% (2) ACF heterocigotos y el 14.3% (9) no concordaron con ACF. Este método ha sido reportado por otros autores9,10,11, quienes lo han utilizados para diagnóstico prenatal de hemoglobina S, tanto en fetos como en líquido amniótico, por lo que lo han considerado un método accesible.
La identificación del genotipo es de gran importancia porque así mismo se valora el estado del paciente, por ejemplo la mayoría de los pacientes heterocigotos (HbS) son portadores del gen de la hemoglobina S defectuosa, son asintomáticos o tienen una sintomatología leve, por lo que llevan una vida normal y no necesitan tratamiento a no ser que se expongan a ciertos estímulos ambientales o presenten alguna infección, sin embargo juegan un rol genético-reproductivo por lo que pueden heredar la mutación a su descendencia, en tanto los pacientes homocigotos (HbSS), presentan la enfermedad con signos y síntomas que deben ser tratados oportunamente para mejorar su calidad de vida y evitar complicaciones1,2,13.
Es importante señalar que en este estudio se encontraron nueve pacientes que no eran ACF, tal como habían sido diagnosticado clínicamente, por lo que se hace necesario realizar otros estudios de laboratorio para ver que otras hemoglobinopatías están asociadas a la clínica que presentaron estos pacientes.
CONCLUSIONES
En este estudio, la mayoría de los niños que buscan asistencia por anemia falciforme en el Hospital Infantil Manual de Jesús Rivera “La Mascota”, son homocigotos 82.5%, mientras que sólo un 3.2% son heterocigotos, lo cual es de esperar, conociendo la presentación clínica de ambos estados. El 14.3% de los electroferogramas (9 niños), no fueron consistentes con anemia falciforme, lo que nos conduce a la necesidad de examinar otros tipos de hemoglobinopatías. Podemos decir que el PCR-RFPL es un método de gran utilidad en el diagnóstico de los genotipos de ACF, por lo que la implementación del método en el hospital contribuiría a un diagnóstico temprano y oportuno de los pacientes, por lo tanto, a un adecuado manejo clínico, lo que contribuirá a mejorar la calidad de vida de estos pacientes.
AGRADECIMIENTOS
Nuestro agradecimiento a los padres de familia de los pacientes que participaron en el estudio y a la UNAN-Managua por el financiamiento de este trabajo, a través del fondo para proyecto de investigación (PFI).
REFERENCIAS BIBLIOGRÁFICAS
- Tirado, I. S. & Zárate, A. C. (2018). Anemia de células falciformes en pediatría: revisión de la literatura. [Pregrado Medicina]. Repositorio Institucional UNAB http://hdl.handle.net/20.500.12749/9962
- Díaz-Morejón L, Rodríguez-Jorge B, García-Sánchez D, León-Rayas Y, Aguilar-Lezcano L, Santacruz-Leonard M. Anemia drepanocítica: características generales de los pacientes a su diagnóstico. Revista Finlay [revista en Internet]. 2019 [citado 2019 Abr 11]; 9(1):[aprox. 6 p.]. Disponible en: http://www.revfinlay.sld.cu/index.php/finlay/article/view/681
- Zúñiga P, Martínez C, González L, Rendón D, Rojas N, Barriga F, Wietstruck M. Enfermedad de células falciformes: Un diagnóstico para tener presente. Rev Chil Pediatr. 2018; 89(4)
- Ayala A, González H, David G. Anemia de células falciformes: una revisión. Salud Uninorte. Barranquilla. [Internet]. 2016; 32 (3): 513-527. Available from: http://www.scielo.org.co/scielo.php?script=sci_arttext&pid=S0120-55522016000300014&lng=en.
- Soler NG, Escalona MLZ, Peña LK. Nuevos aspectos moleculares y fisiopatológicos de la anemia drepanocítica. Rev cubana med. 2021;60(1):1-10. https://www.medigraphic.com/cgi-bin/new/resumen.cgi?IDARTICULO=105575
- Organización Mundial de la Salud (OMS. Anemia falciforme: Informe de la Secretaría. 59ª Asamblea Mundial de la Salud. A59/9, 24 de abril de 2006. https://apps.who.int/gb/archive/pdf_files/ WHA59/A59_9-sp.pdf
- Svarch Eva, Machín García Sergio Arturo. Epidemiología de la drepanocitosis en países de América Latina y del Caribe. Rev Cubana Hematol Inmunol Hemoter [Internet]. 2020 Jun [citado 2025 Jun 25] ; 36( 2 ): . Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-02892020000200002&lng=es. Epub 01-Oct-2020.
- Borrero Y, Chiang C, García M, León C, Casanova M. Programa de Diagnóstico y Prevención de Anemia Falciforme en el Centro de Genética Médica de Camagüey. 2017. Disponible en: http://www. tecnosaludcmw2017.sld.cu/index.php/socoenf/tecnosalud2017/paper/view/11
- Cervera I, García M, Collazo T. Estudio molecular de anemia falciforme. Frecuencia de los alelos βS y βC en pacientes estudiados en el año 2010. Rev. Medisur [Internet]. 2012 Oct [citado 2017 Ene 20]; 10(5): 365-9.
- García M, Collazo T, Gómez M. Diagnóstico prenatal molecular de anemia falciforme. 2010-2016. Revista Cubana de Hematología, Inmunología y Hemoterapia. 2017 [citado 2017 Ene 20]; 36 (Suplemento). http://www.revhematologia.sld.cu/index.php/hih/article/view/635/683
- Ngole, Mamy et al. “DNA testing for sickle cell anemia in Africa: Implementation choices for the Democratic Republic of Congo.” Journal of clinical laboratory analysis vol. 36,5 (2022): e24398. doi:10.1002/jcla.24398
- Marenco Mercado G. Caracterización Clínico Epidemiológico de los pacientes con Diagnóstico de Anemias Hemolíticas en el Servicio de Hematología del Hospital Infantil Manuel de Jesús Rivera “La Mascota” en el periodo comprendido Enero 2011 – Diciembre 2015. [Tesis] Universidad Nacional Autónoma de Nicaragua; 2016. 51p. disponible en: http://repositorio.unan.edu.ni/3235/1/67832.pdf.
- López Rivas M. Epidemiología de la anemia drepanocítica y características clínicas de la enfermedad de los pacientes atendidos en sala de hematología del Hospital Infantil Manuel de Jesús Rivera La Mascota 2000- 2004. [Tesis] Universidad Nacional Autónoma de Nicaragua; 2015. 43p. disponible en: https://www.academia.edu/8692378/ANEMIA_DREPANOCTICA
 .
.