Resistencia a insecticidas mediante ensayos moleculares en Anopheles albimanus en la Costa Caribe Norte de Nicaragua
Insecticide resistance through molecular assays in Anopheles albimanus in the Northern Caribbean Coast of Nicaragua
Holvin Martin Gutiérrez Pérez
Ministerio de Salud, Nicaragua
https://orcid.org/0009-0005-8624-0017
gholvinmartin@yahoo.com
Francisco José Mayorga Marín
Universidad Nacional Autónoma de Nicaragua, Managua. Centro de Investigaciones y Estudios de la Salud. UNAN-Managua/CIES, Nicaragua.
https://orcid.org/0000-0002-9260-8341
francisco.mayorga@cies.unan.edu.ni
RECIBIDO
25/09/2024
ACEPTADO
08/04/2025
RESUMEN
La malaria es una enfermedad tropical ocasionada por parásitos del género Plasmodium spp. y es transmitida por mosquitos del género Anopheles spp, siendo un problema de Salud Pública a nivel mundial (OMS, 2022). En Nicaragua, la mayoría de los casos se presentan en la Costa Caribe y a pesar de los esfuerzos realizados por el Ministerio de Salud, su frecuencia ha aumentado en los últimos años. Esto, es debido a varios factores entre lo que se destaca, la presencia de genes de resistencia a insecticidas en los mosquitos transmisores asociado al uso histórico de piretroides en las intervenciones de control. Por tanto, el presente estudio, tuvo el propósito de evaluar la resistencia a insecticidas mediante desarrollo de ensayos moleculares en Anopheles albimanus del barrio Alemán del municipio de Puerto Cabezas, Región Autónoma Costa Caribe Norte en el segundo semestre del 2022. Es un estudio cuantitativo, analítico de corte transversal, la muestra estuvo conformada por mosquitos hembra de Anopheles albimanus colectados en el barrio Alemán. Para determinar la susceptibilidad y mecanismos de resistencia a insecticidas se utilizaron pruebas biológicas, pruebas de actividad enzimática y pruebas moleculares. Se reportó resistencia a etofenprox con un porcentaje de mortalidad de 53% y a deltametrina con un 29% de mortalidad. Los Anopheles albimanus presentaron un mecanismo metabólico involucrado parcialmente para Etofenprox y totalmente involucrado para Deltametrina. Se encontró que el 79% posee la mutación kdr la cual confiere resistencia a insecticidas piretroides. En Nicaragua, se reporta resistencia a insecticidas asociadas a la mutación kdr. Es necesario continuar con la vigilancia y el seguimiento de la resistencia a insecticidas por medio de la aplicación sistemática de pruebas biológicas, moleculares y enzimáticas para la creación de un programa de rotación de insecticidas.
PALABRAS CLAVES
Malaria; Anopheles albimanus; resistencia a insecticidas; técnicas de diagnóstico molecular.
ABSTRACT
Malaria is a tropical disease caused by parasites of the genus Plasmodium spp. and is transmitted by mosquitoes of the genus Anopheles spp. and is a worldwide public health problem (WHO, 2022). In Nicaragua, most cases occur in the Caribbean Coast and despite the efforts made by the Ministry of Health, its frequency has increased in recent years. This is due to several factors, including the presence of insecticide resistance genes in mosquitoes associated with the historical use of pyrethroids in control interventions. Therefore, the present study had the purpose of evaluating insecticide resistance through the development of molecular assays in Anopheles albimanus in the Alemán neighborhood of the municipality of Puerto Cabezas, Northern Caribbean Coast Autonomous Region in the second semester of 2022. It is a quantitative, analytical, cross-sectional study, the sample consisted of female Anopheles albimanus mosquitoes collected in the Alemán neighborhood. Biological tests, enzyme activity tests and molecular tests were used to determine susceptibility and mechanisms of resistance to insecticides. Resistance to etofenprox was reported with a 53% mortality rate and to deltamethrin with a 29% mortality rate. The Anopheles albimanus presented a metabolic mechanism partially involved for Etofenprox and totally involved for Deltamethrin. It was found that 79% possess the kdr mutation which confers resistance to pyrethroid insecticides. In Nicaragua, resistance to insecticides associated with the kdr mutation is reported. It is necessary to continue surveillance and monitoring of insecticide resistance through the systematic application of biological, molecular and enzymatic tests for the creation of an insecticide rotation program.
KEYWORDS
Malaria; anopheles albimanus; insecticide resistance; molecular diagnostic techniques.
INTRODUCCIÓN
La malaria es una enfermedad tropical ocasionada por parásitos del género Plasmodium y transmitida por mosquitos del género Anopheles, esta enfermedad afecta al ser humano desde tiempos remotos y continúa siendo un grave problema de Salud Pública. En el informe mundial sobre la malaria del año 2022, se reportaron 247 millones de casos de malaria en 84 países donde la enfermedad es endémica, observándose un aumento respecto a los 245 millones de casos registrados en el 2020 (OMS, 2022).
En Nicaragua, este incremento de casos se ha observado desde el año 2015. A pesar de los esfuerzos realizados por el Ministerio de Salud y de los organismos de cooperación externa, el aumento de casos es significativo, reportándose 2,307 en el 2015 y 25,530 caso en el año 2020, predominando la infección por P. vivax (53%) y P. falciparum (47%). En el año 2021, la Región Autónoma del Caribe Norte, reportó el mayor número de casos a nivel nacional con un 97%, presentándose una mayor frecuencia en los municipios de Puerto Cabezas (área urbana), Waspam y Prinzapolka. (MINSA, 2022).
Este incremento de casos a nivel nacional e internacional se ha asociado a diversos factores, según reportes de la Organización Mundial de la Salud (2018). Entre estos factores destaca la interrupción de los servicios durante la pandemia de COVID-19 y el desarrollo de genes de resistencia a insecticidas en los mosquitos transmisores. Ello, debido al uso histórico y continuo de DDT y otros piretroides en el Rociado Residual Intradomiciliar (RRI) que se implementa como parte de las estrategias de control vectorial, además de la utilización de mosquiteros tratados con insecticidas de larga duración como la Deltametrina.
Es importante mencionar que, se conocen más de 400 especies de anofelinos, de los cuales 68 se asocian a casos de malaria o paludismo. El Anopheles albimanus es uno de los principales vectores de malaria de América Latina y está ampliamente distribuido en la región (Kettle, 1995). En años recientes, investigadores de la región han revelado la existencia de resistencia a insecticidas (RI) en Anopheles albimanus (Guerrero et al., 2021).
La resistencia a los insecticidas se define como la capacidad que tienen los mosquitos de sobrevivir a la exposición a una determinada dosis de insecticida, rasgo que puede ser de origen fisiológico o resultar de una conducta adaptativa (Panini et al., 2016).
Existen varios mecanismos que les permiten a los insectos resistir a la acción de los insecticidas. Los 4 mecanismos más reconocidos son: la reducción de la penetración del insecticida, el comportamiento de evitación, la resistencia metabólica y la resistencia en el sitio blanco (González, 2015). De estos, los dos principales son la resistencia generada por incrementos en la tasa de degradación metabólica del insecticida y la resistencia generada por modificaciones en el sitio blanco del insecticida, éste ocurre cuando el insecticida no logra unirse de forma efectiva a su sitio de acción porque éste ha sido modificado debido a la presencia de mutaciones puntuales no silenciosas en genes estructurales (Hemingway y Ranson, 2000).
En América Latina, se ha reportado resistencia a las cuatro clases principales de insecticidas, se ha detectado que al menos una población de A. albimanus, An. aquasalis, An. benarrochi s.l., An. darlingi, An. nuneztovari s.l. y An. pseudopunctipennis s.l. presentan resistencia, siendo la especie mayormente reportada An. albimanus en Colombia, Guatemala, México, Panamá y Perú (González, 2009) (Fonseca-González et al., 2009).
En el año 2021, mediante la metodología de papeles impregnados se realizaron ensayos en el municipio de Puerto Cabeza por el equipo de Entomología médica del Centro Nacional de Referencia (CNDR) del Ministerio de Salud. Dichos ensayos, evidenciaron que las poblaciones de mosquitos toleraban las dosis diagnósticas de los insecticidas evaluados, identificando por primera vez, la presencia de genes resistencia a los insecticidas Etofenprox y Deltametrina en poblaciones de mosquitos de Anopheles albimanus principal vector de malaria en la Costa Caribe de Nicaragua (MINSA, 2022).
Por otra parte, la resistencia cruzada es el mecanismo por el cual un gen simple confiere resistencia a un número de químicos del mismo grupo, tal es el caso de las fosfotriesterasas que brindan resistencia a varios organofosforados, o a diferentes grupos, como el gen kdr que confiere resistencia al DDT y a los piretroides (WHO, 1957).
Las mutaciones del gen VGSC, producen cambios en la secuencia de aminoácidos del segmento seis del dominio dos de la proteína y en el lazo intracitoplasmático de unión de los dominios tres y cuatro de la proteína. Son también conocidas como mutaciones KDR o resistencia KDR (Knoc-down), por la capacidad que tienen los insectos con estas mutaciones para soportar la exposición prolongada a los insecticidas sin ser “derribados” (Orjuela, 2019).
En el mundo, se han descrito nueve mutaciones no silenciosas en el gen VGSC (L1014F, L1014S, L1014C, L1014W, N1013S, N1575Y, V1010L, I1048N y S1156G), en 14 especies de vectores de malaria (Anopheles gambiae, Anopheles arabiensis, Anopheles sinensis, Anopheles stephensi, Anopheles subpictus, Anopheles sacharovi, Anopheles culicifacies, Anopheles sundaicus, Anopheles aconitus, Anopheles vagus, Anopheles paraliae, Anopheles peditaeniatus, An. coluzzi y Anopheles albimanus). En las Américas, estas mutaciones sólo han sido investigadas en la especie Anopheles albimanus, en la cual se identificaron dos (L1014C y L1014F) en muestras provenientes de México, Nicaragua y Costa Rica (Orjuela, 2019).
Para conocer el perfil de susceptibilidad a los insecticidas en las poblaciones de Anopheles albimanus se recomienda el uso de pruebas biológicas en las cuales los vectores son expuestos a concentraciones del insecticida por un tiempo fijo y se registran los porcentajes de mortalidad. En el bioensayo recomendado por la OMS, se utilizan cuatro tubos con papeles impregnados con insecticidas, en el que se deben colocar de 20 a 25 hembras adultas de mosquitos en cada tubo; mientras que 20 a 25 mosquitos se colocan en un tubo con papel impregnado en aceite de silicona constituyendo el grupo “control”. Luego, se debe registrar la mortalidad en cada grupo: expuestos y no expuesto. Esta prueba resulta útil para una rápida identificación de resistencia a insecticidas, sobre todo en países en vías de desarrollo como Nicaragua (OMS, 2017).
En los últimos años, ha surgido un interés científico sobre esta temática; principalmente porque la vigilancia de la resistencia a los insecticidas forma parte de las actividades de control de la enfermedad y permite la realización de ajustes en las estrategias previamente diseñadas por las autoridades sanitarias.
La realización de estudios científicos entorno a esta situación es clave para proporcionar información objetiva y confiable al Componente Nacional de la Malaria, el cual puede utilizar esta información para efectuar la planificación operativa y mantener el control del vector de la malaria a través del uso insecticidas eficaces.
La detección de resistencia a insecticidas de forma rutinaria permite tomar decisiones basadas en evidencia científica en donde se valore la incorporación de mejoras en las intervenciones implementadas por el Ministerio de Salud para el control de la enfermedad, facilitando de esta manera, la selección de insecticidas que resulten eficaces para la eliminación del mosquito vector que predomina en las zonas con mayor prevalencia.
Tomando en cuenta lo anterior, el presente estudio tuvo el objetivo de evaluar la resistencia a insecticidas mediante desarrollo de ensayos moleculares en Anopheles albimanus del barrio Alemán del municipio de Puerto Cabezas, Región Autónoma Costa Caribe Norte, en el segundo semestre del 2022.
MATERIALES Y MÉTODOS
Se realizó un estudio cuantitativo, analítico de corte transversal, utilizando pruebas biológicas, pruebas de actividad enzimática y pruebas moleculares para determinar la susceptibilidad y mecanismos de resistencia a insecticidas de los mosquitos. El área de estudio fue el barrio Alemán, municipio de Puerto Cabezas, Región Autónoma Costa Caribe Norte (RACCN).
La muestra estuvo constituida por 225 mosquitos Anopheles albimanus colectados en un corral bovino del barrio Alemán durante cuatro horas (17:30 y 20:30 horas) correspondiente a las “horas pico” de actividad del mosquito. La identificación taxonómica de los mosquitos colectados se realizó en el laboratorio de entomología médica del SILAIS Bilwi.
La fuente de información fue primaria, se utilizaron datos registrados por el programa de control vectorial del municipio de Puerto Cabezas, RACCN.
Técnicas e instrumentos de recolección de datos
Como instrumento de recolección de datos se utilizó el formato de la OMS para prueba de susceptibilidad por papeles impregnados. El instrumento de recolección, estuvo conformado por los formularios establecidos por OMS para el registro de las observaciones del bioensayo y el formato de registro para pruebas moleculares.
Etapas de investigación
Etapa 1. Evaluación de la susceptibilidad de los mosquitos a insecticidas
Para evaluar susceptibilidad a insecticidas se realizó la metodología de bioensayo de la OMS (papeles impregnados), la cual consiste en utilizar 5 tubos de exposición de los cuales un tubo se utiliza para control y esta recubierto con papel impregnado en aceite de silicona y cuatro tubos con papeles impregnados con insecticidas a una dosis diagnóstica que en poblaciones susceptible provocaría el 100 de mortalidad de los mosquitos expuestos.
Los bioensayos se realizaron al día siguiente de la colecta de mosquitos, para descartar cualquier hembra que no tenga buena condición fisiológica. Fueron expuestos en total 225 mosquitos de los cuales: 25 fueron colocados en el tubo control para descartar mortalidad por manipulación y generar sesgos durante las lecturas. En los tubos con papeles de insecticidas se colocaron 25 mosquitos por cada uno para un total de 200 mosquitos expuestos a insecticidas (100 a etofenprox y 100 a deltametrina).
Las poblaciones de mosquitos fueron expuestas por 60 minutos a insecticidas, realizando la primera lectura (mosquitos caídos), una vez concluido este periodo. Luego se realizó otra lectura a las 24 horas (tiempo diagnóstico) (mosquitos muertos).
Los individuos que resultaron resistentes a la dosis diagnóstica 1X de los insecticidas evaluados (etofenprox 0.5% y deltametrina 0.05%.) fueron inmovilizados y se aplicó etanol absoluto. Posteriormente se pasaron por papel absorbente para eliminar excesos del etanol y se introdujeron de forma individual en tubos eppendorf de 0.2 mL con 280 uL de RNA later.
Para determinar la actividad enzimática se utilizó la misma metodología de la prueba de bioensayo de la OMS, con la diferencia de que durante este bioensayo se utilizó un tubo con papel impregnado con sinergista PBO (butoxido de piperonilo). Esto, con el fin de evaluar resistencia metabólica en las poblaciones de mosquitos; si bien el PBO (butoxido de piperonilo) no tiene propiedades plaguicidas por sí mismo, cuando se añade a compuestos plaguicidas, como los insecticidas piretroides, aumenta considerablemente la potencia de estos químicos.
En las pruebas moleculares para la determinación de mutaciones, el laboratorio de biología molecular de la Unidad de Entomología Médica de Malaria, aplicó el procedimiento operativo estándar para la extracción del ADN genómico de mosquitos adultos con DNAzol se separaron las patas para la extracción del ADN y del abdomen se extrajo ARN. Una vez realizada la extracción del ADN de cada mosquito, se procedió a la amplificación del gen kdr (knockdown resistance) mediante la realización de PCR en 34 muestras.
Los expertos en entomología fueron los encargados de realizar las pruebas de susceptibilidad para la detección de mecanismos de resistencia. La información fue revisada por el investigador principal del estudio con asesoría de expertos en entomología.
Es importante señalar que en el proceso de la realización de la prueba de susceptibilidad con papeles impregnados se consideró la probabilidad de observar mortalidad en el grupo control (5-20%), cuando esto aconteció se corrigió la mortalidad media mediante la Fórmula de Abbot:
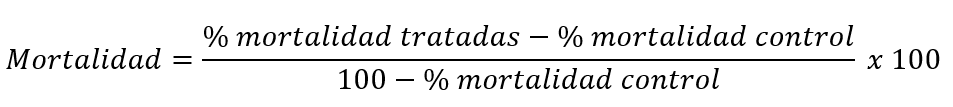
Etapa 2. Procesamiento de la información
Para el procesamiento de la información, se utilizó el programa Microsoft Excel. Los datos se representaron en tablas y gráficos donde se observaba el porcentaje de susceptibilidad y de mortalidad a las 24 horas de exposición a los plaguicidas.
Los resultados de los bioensayos de OMS fueron expresados en porcentajes y se hizo la corrección de Abbott cuando el porcentaje de incapacitación fue del 5 al 20% en las botellas control.
Etapa 3. Elaboración de informe final
En esta etapa se realizó la redacción del informe final. Es importante mencionar que, en el estudio se respetaron los principios bioéticos, se solicitó autorización a los dueños de los corrales para la colecta de los mosquitos y se garantizó la protección necesaria del personal que participó en la colecta de los vectores. Por ser un estudio de interés en Salud Pública, se solicitó autorización a la Dirección General de Vigilancia de la Salud Pública mediante carta formal, el estudio fue aprobado y se autorizó el apoyo de técnicos de entomología del Ministerio de Salud.
RESULTADOS Y DISCUSIÓN
Se realizaron los procedimientos establecidos por la Organización Mundial de la Salud para la detección de resistencia a insecticidas piretroides por medio de bioensayo, encontrándose resistencia a etofenprox con un porcentaje de mortalidad de 53% y a deltametrina con un porcentaje de mortalidad de 29% (figura 1).
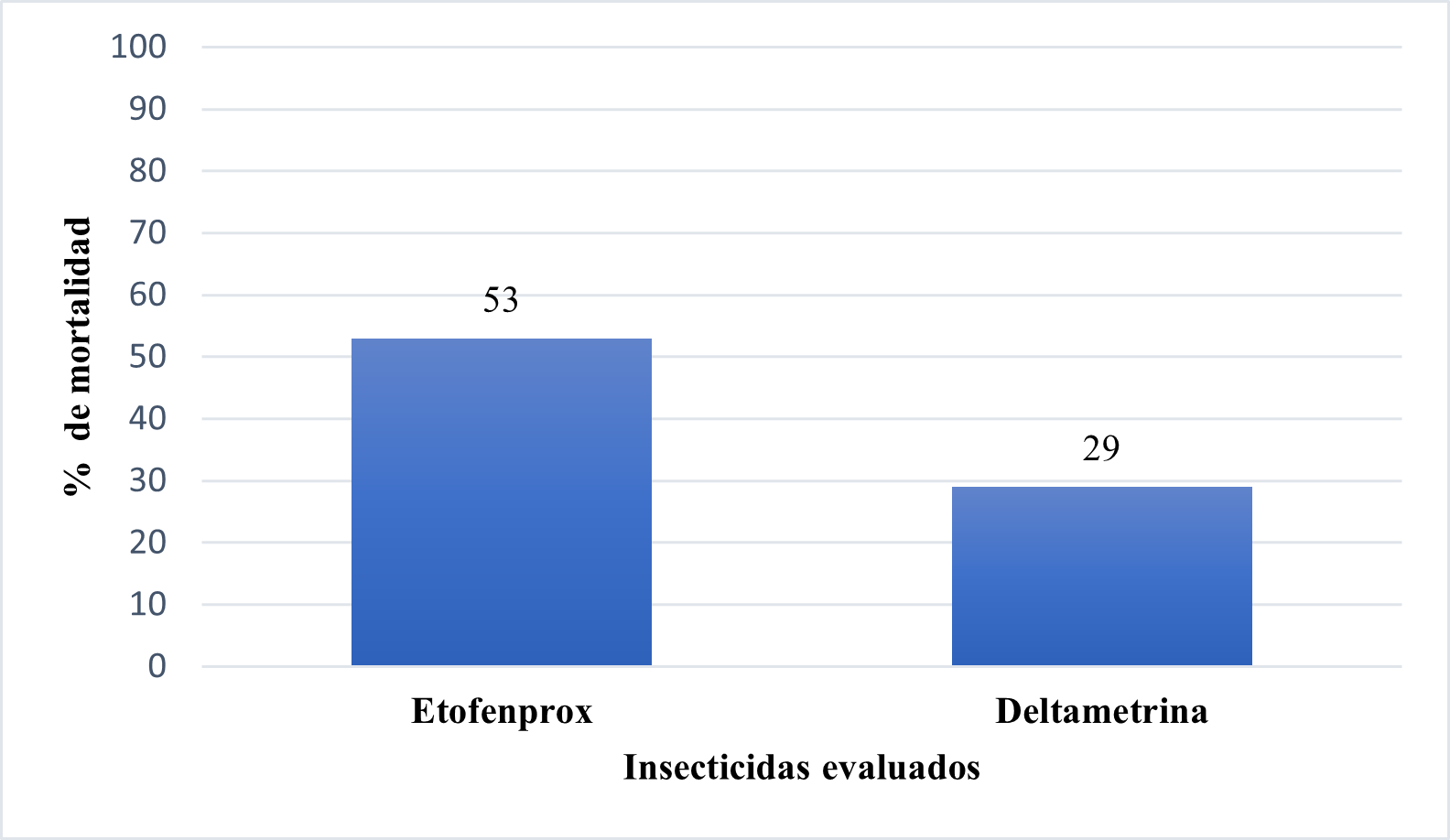
Figura 1. Monitoreo de la resistencia a los insecticidas Piretroides utilizados para control de Anopheles albimanus, Puerto Cabeza – RACCN Barrio Alemán - septiembre 2022. Fuente: Resultados de bioensayo
De acuerdo con las directrices de la Organización Mundial de la Salud (2019), se reconoce la presencia de resistencia a insecticidas cuando los porcentajes de mortalidad son < 90%, mientras que cuando los valores se encuentran en el rango de 98-90 se sospecha resistencia, por lo que se requiere vigilancia y solo cuando el porcentaje de mortalidad es mayor a 98% se considera al mosquito susceptible a los insecticidas. Al respecto es importante destacar que en este estudio se observó resistencia tanto a etofenprox como a deltametrina.
Cabe señalar que, este grupo de insecticidas tiene características en común con el DDT, entre los que destacan el coeficiente negativo de temperatura, el knockdown y actividad killing, que tienen su foco de acción en los canales de sodio del sistema nervioso. Esto explica los efectos neurotóxicos producidos en los insectos; estos elementos que comparten los piretroides con el DDT, han aumentado el riesgo de que los mosquitos desarrollen resistencia a estas sustancias, disminuyendo con esto la eficacia de las intervenciones implementadas por el equipo de control de malaria.
Tabla 1: Criterios de mortalidad para determinación de la resistencia de acuerdo a valores establecidos por la OMS
| Mortalidad | Interpretación |
|---|---|
| 98- 100 | Susceptible |
| 98- 90 | Sospecha de resistencia (Vigilancia) |
| ˂ 90 | Resistente |
Fuente: (OMS, 2019)
Al respecto Guerrero et al. (2021) reportó que el 66.6% de sus poblaciones de vectores tenían resistencia a piretroides. Mientras que Castañeda y Bolaños (2022) menciona que el Anopheles albimanus es el principal vector identificado en los países de Latinoamérica, encontrando resistencia a piretroides para lambda-cihalotrina y DDT. Por otra parte, Solís et al. (2013) identificó resistencia a deltametrina con un porcentaje < 80%.
No obstante, los resultados de este estudio difieren de lo encontrado por Murillo et al. (2018) quienes mostraron susceptibilidad a deltametrina y resistencia a Alfacipermetrina.
La OMS (2019), citado por MINSA (2023), recomienda las rotaciones o rociado en mosaico con formulaciones de insecticidas que tienen un modo de acción diferente en las zonas donde se ha detectado resistencia. Por tanto, resulta necesario ajustar las intervenciones de control vectorial en el territorio en estudio para garantizar que las acciones emprendidas sean efectivas y contribuyan a la reducir la incidencia de casos de malaria. Cabe señalar que, desde el 2022 se aplica Rociado residual con el nuevo insumo Fluodora, el cual se utilizó solamente en casco urbano de Puerto Cabezas, se ha registraron un total de 17,461 casas con cumplimiento de cobertura de 94.2 %, protegiendo a 77,267 habitantes.
Ante la presencia comprobada de resistencia a insecticidas piretroides la Organización Mundial de la Salud, en las Directrices para el control de vectores del paludismo recomiendan el uso de mosquiteros con piretroide más producto sinérgico (BOP). Esta sustancia actúa inhibiendo ciertas enzimas metabólicas del mosquito que detoxifican o secuestran los insecticidas antes de que ejerzan su efecto tóxico en el insecto, es así como, un mosquitero con piretroide y BOP, comparado con otro que solo contiene piretroide, ejerce un efecto más letal contra los vectores del paludismo (OMS, 2019).
Al respecto se han entregado en el municipio de Puerto Cabezas 24,703 MTILD en 56 comunidades protegiendo a un total de 9,310 familias y a 585 embarazadas con cumplimiento de cobertura de 94 % de acuerdo con la Estrategia Nacional para la eliminación de la malaria (MINSA, 2023).
Para establecer la presencia de actividad enzimática asociada a resistencia de etofenprox y deltametrina se realizó la prueba de bioensayo con el sinergista POB (butóxido de piperonilo) y se encontró que los mosquitos Anopheles albimanus presentan un mecanismo de resistencia metabólico involucrado parcialmente para Etofenprox debido a que se observó un aumento en el porcentaje de mortalidad, cambiando de 53% con la dosis diagnóstica a 96% después de la exposición al sinergista (Figura 2).
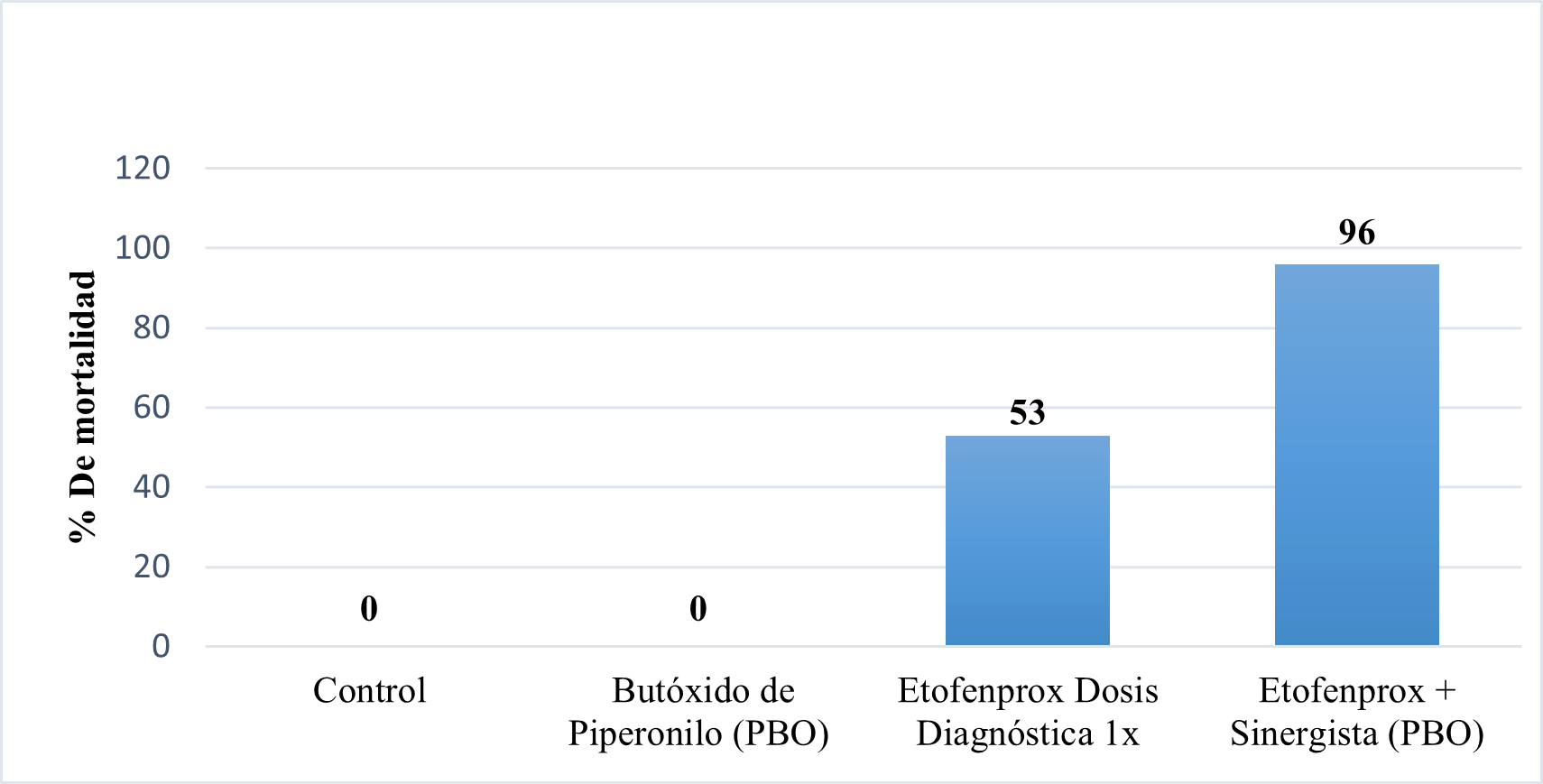
Figura 2. Monitoreo de la resistencia con sinergista e insecticida (Etofenprox) ante Anopheles albimanus mediante prueba de OMS, Puerto Cabezas, segundo semestre 2022. Fuente: Resultados de bioensayo
En el caso de la Deltametrina se identificó un mecanismo metabólico totalmente involucrado debido a que la mortalidad aumentó de 29% con dosis diagnóstica a 100% después de la exposición al sinergista (Figura 3).
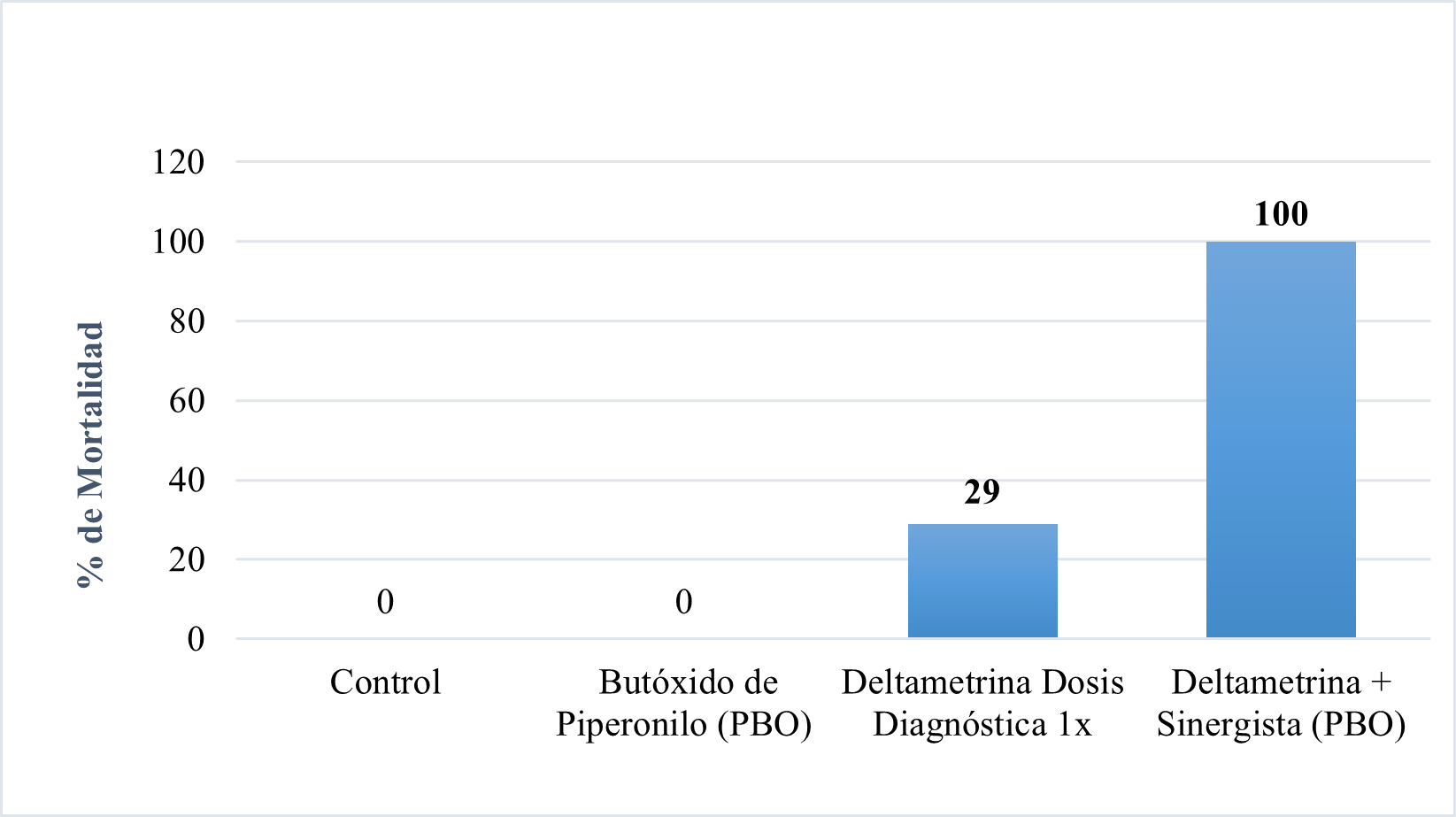
Figura 3. Monitoreo de la resistencia con sinergista e insecticida (Deltametrina) ante Anopheles albimanus, mediante prueba de OMS,Puerto Cabezas, semestre 2022. Fuente: Resultados de bioensayo
Esta prueba evidencia la importancia de incluir un sinergista en los mosquiteros que se brindan a la población ya que aumenta significativamente el efecto del insecticida otorgando mayor seguridad y eficacia.
En este sentido, es importante señalar que los mecanismos de resistencia a insecticidas tienen una base bioquímica y que las dos formas mayormente reportadas son la resistencia en el sitio blanco, que se presenta cuando el insecticida no se enlaza al sitio de acción, es importante señalar que la resistencia asociada a las enzimas detoxificativas, debido a niveles elevados o a la modificación de las esterasas, oxidasas o glutatión-transferasas (GST) evitan que el insecticida alcance su sitio de acción (Flores et al., 2001).
Al respecto, Castañeda y Bolaños (2022) en su revisión, encontró un predominio de resistencia a insecticidas del tipo metabólico, asociado principalmente al aumento de esterasas, glutatión-transferasa y oxidasas de función múltiple o monooxigenasas dependientes de citocromo P-450. Cuando se presentan estos tipos de resistencia la recomendación que emiten las autoridades sanitarias es la rotación de insecticida para garantizar un adecuado control vectorial.
Para caracterizar con mayor precisión los mecanismos de resistencia a insecticidas se utilizaron pruebas moleculares con 34 muestras de Anopheles albimanus, por medio de la Reacción en Cadena de Polimerasa (PCR) y la amplificación del ADN se encontró que el 79% de las muestras analizadas mostraron la mutación kdr la cual confiere resistencia a insecticidas piretroides en el principal vector de malaria en Nicaragua.
En el estudio de genotipificación de la mutación kdr se registró que el 79.4% (27) correspondía a homocigoto resistente TTC (F), el 14.7% (5) registró TTS (F/L) y un 2.9% (1) reportó Heterocigoto TTS (F/L) respectivamente, por tanto, se identificó resistencia a piretriodes asociadas a las mutaciones kdr en el codón 1014 del canal de sodio, al respecto, se conoce que un cambio en la leucina a fenilalanina, cisteína o serina produce precisamente la resistencia a este tipo de insecticidas. En anofelinos, la leucina del codon 1014 puede ser codificada por los nucleótidos TTG o TTA, mientras que la fenilalanina por TTC o TTT, cisteína por TGT, o serina TCA.
Por tanto, queda en evidencia, que la resistencia al insecticida Deltametrina en poblaciones de Anopheles albimanus en Puerto Cabezas; está asociada a mutaciones kdr, encontrándose un cambio de leucina a fenilalanina; lo que confiere resistencia a piretroides; se debe recordar que según Shono (1985) la presencia del gen kdr provoca una baja sensibilidad hacia el DDT y piretroides, lo que se traduce a una resistencia a estos tipos de insecticidas, además que puede proveer una alta resistencia cuando el alelo super-kdr se manifiesta en la especie del mosquito estudiado.
Este hallazgo es sumamente relevante debido a que es la primera vez en Nicaragua que se detecta este tipo de mutación, lo cual es resultado de los avances científicos y tecnológicos que ha fortalecido en Ministerio de Salud.
Los resultados de esta investigación se relacionan con el estudio de López (2016) realizado en Venezuela donde identificó mutaciones puntuales en el gen que codifica para el canal de sodio dependiente de voltaje relacionadas con resistencia a piretroides en Anopheles Sp. circundantes en Venezuela. La identificación de mutaciones puntuales en la posición 1014, relacionadas con la resistencia knockdown a piretroides/DDT, fue posible mediante el alineamiento múltiple de las secuencias nucleotídicas de los productos de PCR, encontrándose las sustituciones L1014F y L1014C, previamente descritas por inducir resistencia knockdown en Anopheles albimanus de Latinoamérica y Anopheles sinensis de China.
Cabe señalar que, los hallazgos de este estudio son similares a los reportados por Orjuela (2019), quien también observó una elevada frecuencia de mutaciones en el gen kdr (knockdown resistance) en poblaciones de Anopheles albimanus en áreas endémicas de Colombia. Ambos estudios sugieren que la presión selectiva ejercida por el uso continuo de insecticidas ha llevado a la selección de estas mutaciones. Sin embargo, mientras Orjuela (2019) se centró en áreas urbanas y rurales de Colombia, este estudio se focalizó en una región específica de Nicaragua, lo que permite evaluar las diferencias geográficas en la evolución de la resistencia.
Adicionalmente, en 10 muestras se identificó que una mutación en el codón 1575 del canal sodio que produce un cambio de asparagina a tirosina incrementa la resistencia causada por mutaciones kdr. En anofelinos, la asparagina del codón 1575 puede ser codificada por los nucleótidos AAC, mientras que la tirosina por TAC (Tabla 2).
Por tanto, el efecto de resistencia a insecticidas piretroides se encuentra potenciado debido a estas mutaciones genéticas en el codón 1575; esto evidencia la importancia de caracterizar genotípicamente a los especímenes en estudio ya que permiten conocer de manera detallada aquellos aspectos genéticos que influyen en la proliferación y supervivencia del vector en el territorio, pese a las estrategias implementadas por el Componente Nacional de Malaria; el uso sistemático de estas pruebas moleculares permite incrementar el conocimiento científico sobre la biología y comportamiento de estos vectores, asimismo, se logra una mayor comprensión de todos los determinantes de la salud que se asocian al desarrollo de la malaria tomando en cuenta las características del vector, el ambiente, el huésped y el agente.
CONCLUSIONES
La población de mosquitos expuesta a dosis diagnóstica 1 X de Deltametrina (0.05%) y Etofenprox 0.5% en el bioensayo OMS resultaron resistentes a los insecticidas. La cepa en estudio presentó inhibición de los mecanismos de desintoxicación parcialmente para Etofenprox y totalmente para Deltametrina. En el 79 % de las muestras evaluadas de Anopheles albimanus, se encontró resistencia a piretroides, asociada a mutación kdr.
Tomando en cuenta los resultados de la investigación resulta necesario continuar con la vigilancia y el seguimiento de la resistencia a insecticidas por medio de la aplicación sistemática de pruebas biológicas y moleculares. De igual manera, el desarrollo de ensayos con sinergista para determinar otros mecanismos enzimáticos involucrados en la resistencia a insecticida en poblaciones de mosquitos de campo que estén sometidas a presión selectiva de insecticida usados en salud pública. Esto contribuirá a la creación de un programa de rotación de insecticidas para preservar la susceptibilidad a estos compuestos químicos, lo cual permitirá un mejor control vectorial.
REFERENCIAS BIBLIOGRÁFICAS
Bisset, J. (2002). Uso correcto de insecticidas: control de la resistencia. Revista Cubana de Medicina Tropical, 54(3), 202-219. Recuperado en 05 de septiembre de 2024, de http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0375-07602002000300005&lng=es&tlng=es.
Castañeda, D. y Bolaños, A. (2022) Resistencia a insecticidas en mosquitos del género Anopheles en América Latina: una revisión sistemática. Universidad de Antioquía. https://bibliotecadigital.udea.edu.co/bitstream/10495/33452/2/Casta%c3%b1edaDaniela_2022_ResistenciaInsecticidaAnopheles.pdf
Flores, A., Badii, M. y Ponce, G (2001) Resistencia a insecticidas en insectos vectores de enfermedades con énfasis en mosquitos. Revista Salud Pública y Nutrición.
Fonseca-González I., Cardenas R., Quinones ML, McAllister J, Brogdon W. (2009) Pyrethroid and organophosphates resistance in Anopheles (N.) nuneztovari Gabaldon populations from malaria endemic areas in Colombia. Parasitology research. 2009;105(5):1399-409.
González J. (2015) Informe final vigilancia de susceptibilidad a insecticidas de Anopheles (Nyssorhynchus) darlingi, An. (N.) nuneztovari y An. (N.) albimanus en localidades centinelas de los departamentos de Antioquia, Cauca, Choco, Córdoba y Valle del Cauca. Año 2009 - 2014 [Internet]; 2015. http://www.ins.gov.co/temas-de interes/Memorias%20Malaria/10.Resistencia%20a%20insecticidas.pdf 7. Quinones ML, Norris DE, Conn JE, Moreno M, Burkot TR, Bugo
Guerrero, R., Lascano, M., López, D. y Figueroa, L. (2021) Vigilancia de la resistencia a los insecticidas organosintéticos en Anopheles albimanus y Aedes aegypti de Ecuador 2019.
Hemingway J. y Ranson H. (2000) Insecticide resistance in insect vectors of human disease. Annual review of entomology. 2000;45(1):371-91.
Kettle, D. (1995) Medical and Veterinary Entomology. Second Edition. CAB International, Wallingford. 658 p.
Ministerio de salud (2023) Informe técnico de consultor para la gestión de foco. Componente Nacional de malaria.
Ministerio de Salud (2023) Análisis epidemiológico. Semanal. Componente Nacional de Malaria. Dirección de Vigilancia de la Salud Pública.
Murillo, O., Padilla, J., Escobar, J., & Morales, C. (2018). Desafíos hacia la eliminación de la malaria urbana/peri en Guapi (Colombia), 2016. Entramado, 14(2), 272-284. https://doi.org/10.18041/1900-3803/entramado.2.4765
Organización Mundial de la Salud (2017) Procedimientos de las pruebas para la vigilancia de la resistencia a los insecticidas en los mosquitos vectores del paludismo – segunda edición [Test procedures for insecticide resistance monitoring in malaria vector mosquitoes – 2nd ed.] ISBN 978-92-4-351157-3 © Organización Mundial de la Salud 2017
Organización Mundial de la Salud. (2018). Informe mundial sobre la resistencia a los insecticidas en los vectores de la malaria: 2010-2016. http://www.who.int/malaria/publications/atoz/9789241514057/en/
Organización Mundial de la salud (2019) Directrices para el control de vectores del paludismo [Guidelines for malaria vector control]https://iris.who.int/bitstream/handle/10665/330723/9789243550497-spa.pdf
Organización Mundial de la Salud (2018) Orientación técnica. Puntos clave y preguntas/respuestas. Estado y tendencias de la resistencia a insecticidas en vectores de malaria.
Organización Mundial de la Salud. (2022). Informe mundial sobre la malaria 2022. Organización Mundial de la Salud.https://www.who.int/publications/i/item/9789240064898
Organización Mundial de la Salud (1957) Séptimo informe Comité de Expertos en Insecticidas OMS Tech Report Ser1957;125:37.
Orjuela, L. (2019) Evaluación de la resistencia a los insecticidas piretroides y DDT en los principales vectores de malaria de Colombia y su asociación con mutaciones en el canal de sodio dependiente de voltaje. Sistema de Universidades Estatales del Caribe Tesis para optar al doctorado en Medicina Tropical.
Panini M, Manicardi G., Moores G., Mazzoni E. (2016) An overview of the main pathways of metabolic resistance in insects. Invertebrate Survival Journal. (cap 13:326-35).
Solís, R., González, R. y Solís, M. (2013) Susceptibilidad de Anopheles albimanus a los insecticidas en cuatro localidades de Tumbes. Memorias del II Congreso Binacional de Investigación, Ciencia y Tecnología de las Universidades. https://dspace.ups.edu.ec/bitstream/123456789/11106/1/Susceptibilidad%20de%20Anopheles%20albimanus%20a%20los%20insecticidas%20en%20cuatro%20localidades%20de%20Tumbes.pdf
ANEXOS
Tabla 1.
Genotipificación de la mutación kdr en muestras de Anopheles albimanus de Nicaragua
| Muestra | Codón 1014 | Resultado | |
|---|---|---|---|
| Genotipo Forward | Genotipo Reverse | ||
| PCR1 | TTC | TTC | Homocigoto resistente: TTC (F) |
| PCR2 | TTC | TTC | Homocigoto resistente: TTC (F) |
| PCR3 | TTC | TTC | Homocigoto resistente: TTC (F) |
| PCR4 | TTS | TTS | Heterocigoto: TTS (F/L) |
| PCR5 | TTC | TTC | Homocigoto resistente: TTC (F) |
| PCR6 | TTC | TTC | Homocigoto resistente: TTC (F) |
| PCR7 | TTC | TTC | Homocigoto resistente: TTC (F) |
| PCR8 | TTC | TTC | Homocigoto resistente: TTC (F) |
| PCR9 | TTC | TTC | Homocigoto resistente: TTC (F) |
| PCR10 | TTC | TTC | Homocigoto resistente: TTC (F) |
| PCR11 | TTC | TTC | Homocigoto resistente: TTC (F) |
| PCR12 | TTS | TTS | TTS (F/L) |
| PCR13 | TTS | TTS | TTS (F/L) |
| PCR15 | TTC | TTC | Homocigoto resistente: TTC (F) |
| PCR16 | TTC | TTC | Homocigoto resistente: TTC (F) |
| PCR17 | TTC | TTC | Homocigoto resistente: TTC (F) |
| PCR18 | TTC | TTC | Homocigoto resistente: TTC (F) |
| PCR19 | TTC | TTC | Homocigoto resistente: TTC (F) |
| PCR20 | TTC | TTC | Homocigoto resistente: TTC (F) |
| PCR21 | TTC | TTC | Homocigoto resistente: TTC (F) |
| PCR23 | TTC | TTC | Homocigoto resistente: TTC (F) |
| PCR24 | TTC | TTC | Homocigoto resistente: TTC (F) |
| PCR25 | TTG | TTG | TTG (L) |
| PCR26 | TTC | TTC | Homocigoto resistente: TTC (F) |
| PCR27 | TTS | TTS | TTS (F/L) |
| PCR28 | TTC | TTC | Homocigoto resistente: TTC (F) |
| PCR29 | TTC | TTC | Homocigoto resistente: TTC (F) |
| PCR31 | TTC | TTC | Homocigoto resistente: TTC (F) |
| PCR33 | TTC | TTC | Homocigoto resistente: TTC (F) |
| PCR35 | TTS | TTS | TTS (F/L) |
| PCR37 | TTS | TTS | TTS (F/L) |
| PCR38 | TTC | TTC | Homocigoto resistente: TTC (F) |
| PCR40 | TTC | TTC | Homocigoto resistente: TTC (F) |
| PCR41 | TTC | TTC | Homocigoto resistente: TTC (F) |
Tabla 2.
Genotipificación de la mutación N1575Y del canal de sodio en muestras de Anopheles albimanus de Nicaragua
| Muestra | Genotipo Reverse | Resultado |
|---|---|---|
| PCR1 | AAC | Homocigoto susceptible: AAC (N) |
| PCR5 | AAC | Homocigoto susceptible: AAC (N) |
| PCR6 | AAC | Homocigoto susceptible: AAC (N) |
| PCR9 | AAC | Homocigoto susceptible: AAC (N) |
| PCR10 | AAC | Homocigoto susceptible: AAC (N) |
| PCR12 | AAC | Homocigoto susceptible: AAC (N) |
| PCR15 | AAC | Homocigoto susceptible: AAC (N) |
| PCR16 | AAC | Homocigoto susceptible: AAC (N) |
| PCR17 | AAC | Homocigoto susceptible: AAC (N) |
| PCR19 | AAC | Homocigoto susceptible: AAC (N) |
Fuente: Laboratorio de biología molecular-Unidad de Entomología Médica de Malaria
© 2025 Revista Científica Estelí.
![]() Este trabajo está licenciado bajo una Licencia Internacional Creative Commons 4.0 Atribución-NoComercial-CompartirIgual.
Este trabajo está licenciado bajo una Licencia Internacional Creative Commons 4.0 Atribución-NoComercial-CompartirIgual.
